酶在所有生物体中普遍存在,行使细胞内催化化学反应的功能。生物酶作为结构支架,能够高效、特异地识别和结合其底物,酶-底物复合物在维持细胞基本活动中发挥着关键作用。一方面,精确催化要求酶与底物识别的唯一性,而另一方面,生物复杂环境的客观性又使得生物酶催化呈现出多样性,这种底物唯一性与大分子构型多样性的和谐统一构成了生物酶学的独有特征,具有重要的基础研究和应用借鉴意义,亟需人们对此展开系统深入探索。
近日,西安交通大学星空体育·(StarSky Sports)官方网站张磊教授课题组与中国科学院物理研究所陆颖课题组基于透射电子显微镜和单分子荧光技术,阐明了生物酶构象催化这一超越化学催化传统框架的新现象,确定了在给定酶-底物相互作用中酶多态性的存在,阐明了构象催化作为生物大分子一种不可或缺的协调机制的重要性。
研究团队以噬菌体T4 DNA连接酶为研究对象进行了深入探索。源自T4噬菌体的DNA连接酶(以下简称T4连接酶)的分子量约为55 kDa,是第一个被发现的三磷酸腺苷(ATP)依赖型连接酶,其DNA复制、重组和修复机制已得到相对广泛的研究,但是对具有不同构象DNA底物的识别和连接反应途径仍然不清楚。为了全面了解该酶的机制,必须对其整体构象的时空动力学行为进行精密观测。包括X射线晶体学和电子显微镜可用于确定多种生物大分子的结构,然而实时观察生物过程时间尺度上的构象变化和化学反应中间过程需要单分子荧光共振能量转移等具有时间分辨率能力的技术支撑。通过将单分子技术与结构确定方法相结合,与生命过程密切相关的动态过程才可以准确呈现。
T4连接酶通过催化DNA分子的3'-OH和5'-PO4末端之间的磷酸二酯键形成,发挥着连接修复DNA链的关键作用。连接反应通常包括三个生化步骤:1)腺苷5'-单磷酸(AMP)从三磷酸腺苷顺序转移至连接酶的活性位点赖氨酸上,形成共价连接酶-AMP中间体;2) AMP转移到DNA缺口位点的5'磷酸,形成共价连接酶-AMP-DNA中间体;3) DNA的腺苷化激活5'磷酸,促进3'-OH的亲核攻击,驱逐AMP并在缺口位点上共价连接两端。
研究团队基于单颗粒电子显微镜成像与重构技术,发现T4连接酶在被AMP结合激活后呈现出四种稳定构象,且在与底物DNA进一步结合后依然保持四种构象,复合物中的DNA弯曲角度大约为0°、20°、60°或100°,显示了T4连接酶的多态催化构象。
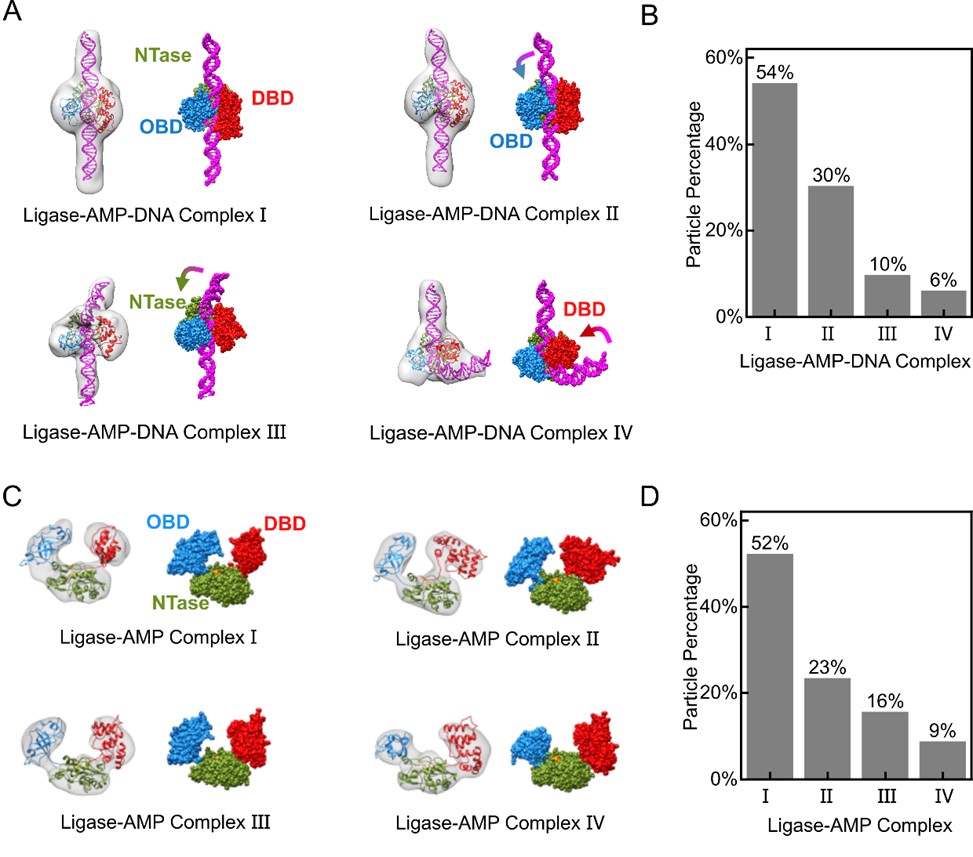
由电子显微镜重构得到的连接酶复合物结构,呈现出明显的四种稳定构象
进一步的单分子荧光实验表明,T4连接酶在结合DNA的过程中,所表现出的四种构象没有先后顺序、呈现平行关系,表明该连接酶不仅可以识别有损伤的DNA底物,而且在修复过程中可以进一步选择不同弯曲程度范围的DNA进行结合。考虑到在实际细胞中,DNA可能处于复杂的空间环境从而具有不同的弯折状态,单一的连接酶构象可能无法匹配多种DNA弯折态,或需要更多的能量消耗并需要其他生物大分子进行辅助结合,而连接酶的多种状态可以根据DNA的不同弯折程度进行高效率、低能耗的结合,显示出了生物进化所导致的生物酶特有的能量消耗“经济性”和复杂环境“适应性”特征。
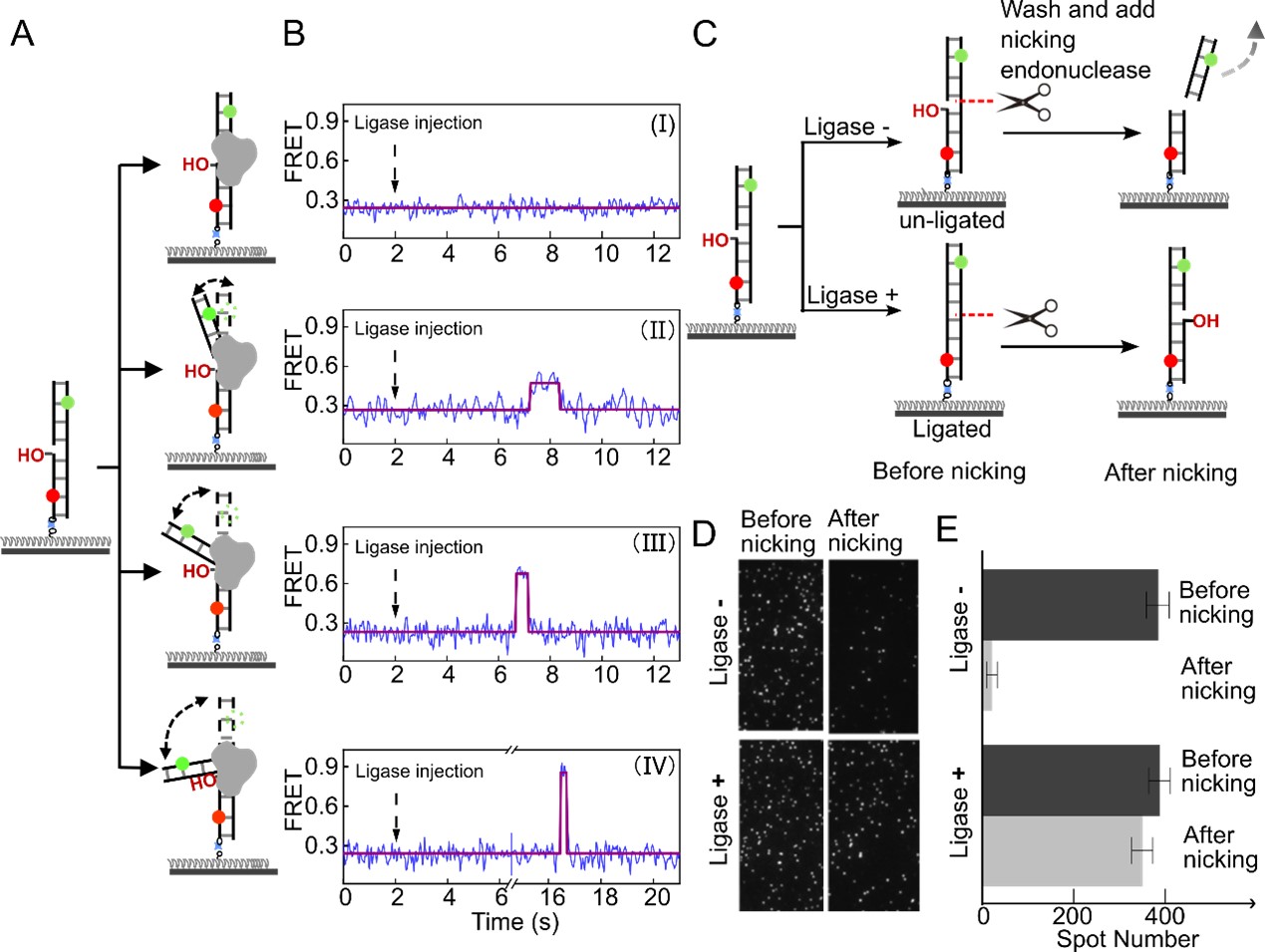
由单分子荧光技术揭示的四个平行DNA修复路径,每条路径可独立应对不同的DNA底物弯折情况
综上所述,研究团队发现T4连接酶在修复DNA过程中可以呈现出四种不同的构象,其特征是DNA的弯曲角分别约为0°、20°、60°和100°。与多构象酶的传统顺序反应步骤的观念相反,T4连接酶的催化过程具有四个并发通路,每个通路与特定的DNA弯曲角相关联。值得说明的是,发现具有单个催化位点的酶存在多条反应通路并不违背底物选择性原理,但是生物酶所表现出的多态构象催化现象可增强对不同底物的催化效率。该工作阐明了简单生物体中酶的进化适应性,是首个探索连接酶催化DNA底物动态结构的研究成果,并对更高级生物有着重要的参考意义,可为真核细胞中其他连接酶复杂功能的研究提供策略框架和技术路径借鉴。
该研究相关成果以“Four Parallel Pathways in T4 Ligase-Catalyzed Repair of Nicked DNA with Diverse Bending Angles”为题2024年4月6日在线发表在期刊《Advanced Science》。西安交大星空体育·(StarSky Sports)官方网站为论文第一单位,博士研究生李娜、副教授杨志伟为共同第一作者,张磊教授与中国科学院物理研究所陆颖研究员、西北农林科技大学侯锡苗教授为共同通讯作者。该项工作获得了国家自然科学基金、中央高校基本科研业务费、西安交通大学青年拔尖人才计划等项目资助,相关表征和测试得到了分析测试共享中心软物质冷冻电镜平台的强力支撑。西安交大软凝聚态物理研究团队以星空体育·(StarSky Sports)官方网站张磊教授、张胜利教授为学术带头人,近三年来重点围绕水环境中微观物质体系的结构功能关键机理问题已连续在Cell、Science、National Science Review、Nature Communications、JACS、Advance Functional Materials、Signal Transduction and Targeted Therapy等国际知名期刊发表成果50余篇。
文章链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202401150